Бесплодие – неспособность супружеской пары к зачатию в результате регулярной половой жизни (половые контакты не реже 1 -2 раз в неделю) без предохранения в течение 1 года.
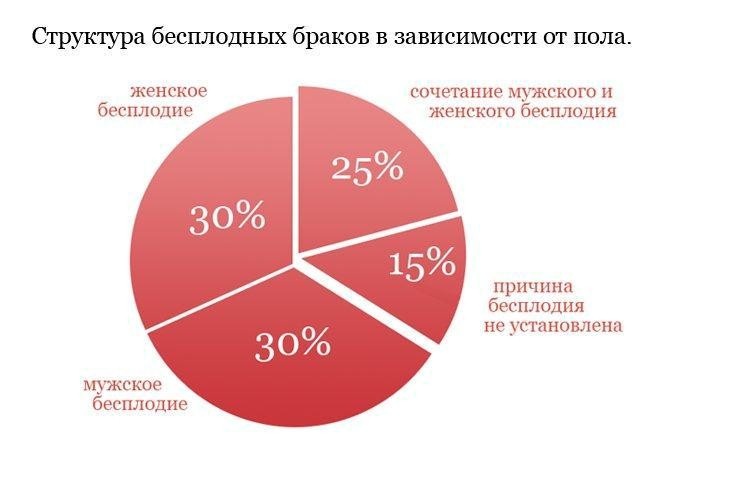
Бесплодие – проблема, с которой сталкивается около 15% супружеских пар по всему миру. Структура бесплодия в зависимости от пола представлена на диаграмме внизу.
Иногда причину бесплодия выявить не удается – ни у женщины, ни у мужчины какие-либо изменения в половой сфере не обнаруживаются, а беременность при этом не наступает. Очевидно, в этих случаях врачи еще не научились выявлять существующими методами расстройства в организме, нарушающие зачатие. В таких случаях говорят об идиопатическом (неясного происхождения) бесплодии. К этой категории относят до 10-15% случаев бесплодия.
О первичном бесплодии говорят, если у женщины никогда не было беременности.
Вторичное бесплодие считается, если у женщины была, хотя бы одна беременность, независимо от того, чем она закончилась — родами, абортом, выкидышем, внематочной беременностью. Определение «первичное» и «вторичное» бесплодие относится не только к женщине, но и к мужчине. Мужское первичное бесплодие означает, что от этого мужчины ни у одной из его партнерш не наступала беременность. Вторичным считается бесплодие, когда от данного мужчины была хотя бы одна беременность, хотя бы у одной из его партнерш.
Наиболее распространенными причинами бесплодия являются трубное и эндокринное (о каждом из них поговорим более подробно ниже).
Но следует помнить, что существуют другие причины ведущие к бесплодию.
-
Бесплодие, связанное с гинекологическими заболеваниями
Различные гинекологические патологии также могут быть причинами бесплодия у женщин, но чаще всего, после излечения заболевания, нарушенная фертильность восстанавливается.
К развитию бесплодия могут привести заболевания шейки матки: эрозия, дисплазия, цервицит (воспаление шейки), половые инфекции и т.д. При этом может нарушиться количество или структура вырабатываемой слизи в канале шейки матки. Если слизь станет слишком плотной или уменьшится ее количество, то сперматозоиды не смогут попасть в маточные трубы и оплодотворить яйцеклетку.
При обследовании часто выясняется, что причиной женского бесплодия является эндометриоз. Эта патология характеризуется разрастанием клеток эндометрия, которые должны находиться только на внутренней поверхности матки, в других органах, например, на яичниках, в мышечном слое матки, в трубах или брюшной полости (более подробно на этом заболевании мы остановимся ниже).
-
Ранний климакс
Одной из редких причин бесплодия может быть такая причина как преждевременное истощение функции яичников или ранний климакс. Обычный возраст женского климакса — 50-55 лет, но у некоторых женщин резерв фолликулов (и яйцеклеток) по невыясненным причинам исчерпывается раньше, менструации прекращаются в 40-45 лет и даже ранее.
В ряде случаев это состояние удается преодолеть при помощи гормонального лечения.
-
Иммунологическое бесплодие
Наиболее малоизученной причиной бесплодия у женщин является образование в цервикальной слизи антиспермальных антител, которые уничтожают сперматозоиды. При таком виде бесплодия и при проходимых маточных трубах, часто предлагают процедуру внутриматочной инсеминации, в процессе которой сперматозоиды вводятся непосредственно в матку, не соприкасаясь с цервикальной слизью.
-
Психологическое бесплодие
Не всегда причиной бесплодия у женщины становятся физические нарушения в репродуктивной системе. Стрессовые ситуации, тревожность, негативные эмоции также могут снизить вероятность зачатия или же полностью исключить его до тех пор, пока психическое состояние не нормализуется.
-
Абсолютное, генетическое бесплодие
Причиной бесплодия у женщины репродуктивного возраста иногда оказываются грубые генетические аномалии: отсутствие матки, яичников или труб. Если бесплодие (обычно – первичное) вызвано генетическими причинами, оно сопровождается полным отсутствием созревания яйцеклеток. Так, например, синдром Тернера, при котором девочки рождаются с недоразвитыми яичниками, либо с полным отсутствием (агенезией) яичников или их резким недоразвитием (синдром дисгенезии гонад).
-
Трубное бесплодие
Причиной женского бесплодия, связанного с маточными трубами, является закрытие трубного канала и /или функциональная несостоятельность маточных труб, которая препятствует продвижению половых клеток. Чаще всего перекрытие возникает за счет образования спаек внутри или снаружи маточных труб.
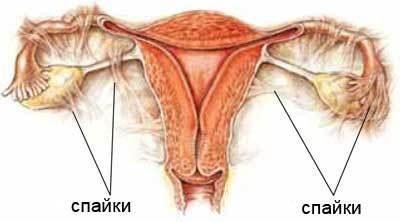
Причины образования спаек – это воспалительные заболевания половой системы.
Риск развития или обострения воспалительных процессов повышают аборты, сложные роды или травмы, гинекологические операции.
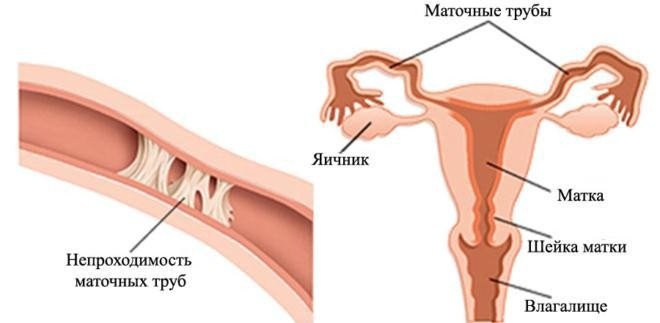
Маточная труба (синонимы: фаллопиева труба или яйцевод) является парным органом и представляет собой цилиндрический канал (трубку), один конец которой открывается в брюшную полость, а другой в полость матки. Длина маточных труб достигает 10 – 12 см, причем правая труба несколько длиннее левой.
Один конец маточной трубы открывается в полость матки, а другой заканчивается фимбриями (ворсинками) и открывается в брюшную полость, недалеко от яичника. С помощью этих 2-ух отверстий брюшная полость сообщается с внутренними и наружными половыми органами женщины, что увеличивает риск восходящей инфекции, например, при воспалении влагалища. Стенка маточной трубы состоит из трех слоев: наружный – представлен брюшиной, он защищает трубу от негативных влияний; мышечный – образован мышечными волокнами и благодаря которым труба совершает перистальтические (сократительные) движения в сторону полости матки; внутренний слой – покрыт мерцательным эпителием, реснички которого волнообразно двигаются (мерцают), что облегчает движение оплодотворенной яйцеклетки в сторону матки; кроме того, в слизистом слое трубы есть железы, которые вырабатывают секрет, поддерживающий постоянство внутренней среды маточной трубы и жизнеспособность яйцеклетки, сперматозоидов и зиготы.
Причины непроходимости маточных труб
Основными причинами непроходимости маточных труб являются:
- Воспалительные процессы в женских половых органах (могут протекать при отсутствии жалоб типичных для воспаления — боли, повышение температуры тела).
- Различные операции, в брюшной полости, в том числе, операции на внутренних половых органах.
- Врожденные дефекты (редко).
- Воспалительные процессы в женских половых органах как причина непроходимости маточных труб
Различные инфекционные заболевания, в том числе и ЗППП являются причиной воспаления маточных труб и образования спаек. Они представляют собой пленки соединительной ткани различной толщины, которые сужают просвет трубного канала и, как следствие, становятся причиной трубного бесплодия. При этом соединительная ткань может появляться как внутри трубы, так и вокруг нее, сдавливая канал, изменяя анатомическую структуру трубы и, создавая непроходимость маточных труб, что делает невозможным продвижение половых клеток.
Последствия перенесенного воспаления могут проявляться в различных вариантах, или это может быть сочетание нескольких вариантов.
- При одном варианте погибают ворсинки мерцательного эпителия слизистого слоя, а мышечный слой перестает сокращаться (исчезает перистальтика). При этом нарушается функция маточных труб, хотя само строение их визуально не меняется. На данном этапе маточные трубы могут быть проходимы, и даже при выполнении лапароскопии визуально не изменены, но за счет нарушения их функции беременность не будет наступать.
- Другой вариант изменений возникает вследствие воспаления маточной трубы:разрастаются спайки, что нарушает ее проходимость, а фимбрии (ворсинки) концевого отдела трубы склеиваются. Во многих случаях при таком варианте маточная труба не увеличена в размерах.
- При третьем варианте спайки закрывают оба отверстия маточной трубы.
- таком образовавшемся замкнутом пространстве начинает скапливаться слизь, которая при воспалении, усиленно вырабатывается железами внутреннего слоя маточной трубы. В результате труба расширяется, увеличивается в размерах, превращается в мешотчатое образование. Такое образование маточной трубы называется гидросальпинкс. В переводе с латинского языка, слово «гидро» переводится как жидкость, а «сальпинкс» означает труба.
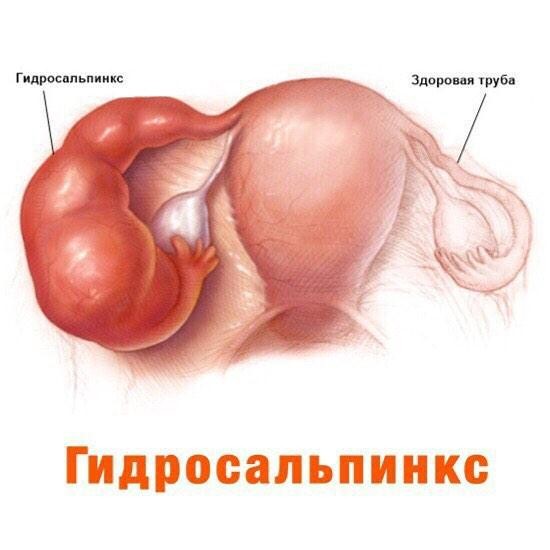
Если происходит нагноение серозно-слизистого содержимого трубы, то образуется пиосальпинкс.
Редко, при неполном спаивании фимбрий, образуется так называемый «вентильный гидросальпинкс», который периодически прорывается за счет давления скопившейся жидкости. Повышение давления происходит при резкой перемене положения тела, при натуживании, в процессе проведения гистеросальпингографии. При этом жидкость изливается в малый таз, что может протекать с болевым синдромом, или без него.
- Операции также могут являться причиной непроходимости маточных труб
Различные оперативные вмешательства как внутри матки (аборты, выскабливания), так и в брюшной полости (на маточных трубах, матке, яичниках) способствуют образованию спаечного процесса, что также может привести к трубному бесплодию. Следует подчеркнуть, что при проведении любой полостной операции (например, операции по поводу аппендицита) могут образовываться спайки в результате, так называемого, асептического воспаления. Распространенность спаечного процесса трудно прогнозировать
У каждого пациента. Одинаковые по объему операции у разных людей, могут приводить к развитию спаечного процесса различной распространенности.
Так же, выполненная небольшая по объему операция у одного пациента, приводит к распространенному спаечному процессу, а у другого после объемной операции в брюшной полости, в случае повторной операции, выявляется минимальное количество спаек.
- Врожденные дефекты
В качестве причины трубного бесплодия можно также рассматривать частичное или полное отсутствие труб, явившееся результатом генетических аномалий.
Симптомы трубного бесплодия и непроходимости маточных труб
В большинстве случаев непроходимость маточных труб не проявляет себя болями или недомоганием, то есть женщина может долгое время вообще не догадываться об этой патологии.
Нарушение функционирования маточных труб возникает вследствие воспалительных заболеваний органов малого таза, чаще всего сальпингита или сальпингоофорита.
После одного эпизода воспалительного заболевания малого таза бесплодие и спаечный процесс отмечается у 13% женщин, после двух эпизодов — у 30%, после трех — у 60%.
Главный симптом непроходимости маточных труб является отсутствие беременности в течение года при регулярной половой жизни, без предохранения.
Также, из-за нарушения проходимости маточной трубы, оплодотворенная яйцеклетка может имплантироваться в трубе, и тогда возникает внематочная (трубная) беременность. На определенном этапе развития этого процесса, дают о себе знать острые боли внизу живота, тошнота, потемнение в глазах, обморок. Подобные состояния требуют немедленной госпитализации. Степень проходимости и различные симптомы непроходимости маточных труб (спайки, анатомические изменения состояния труб, некоторые признаки воспаления), может оценить только врач.
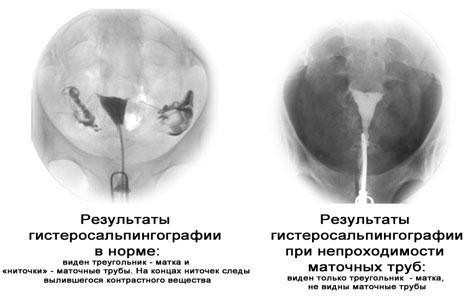
Диагностика трубного бесплодия (непроходимости маточных труб)
Диагностика непроходимости маточных труб позволяет оценить состояние женских придатков и уточнить причины бесплодия.
Для этого могут быть применены следующие методы:
- гистеросальпингография
- соногистеросальпингоскопия
- фертилоскопия
- лапароскопия
Гистеросальпингография (ГСГ)
Гистеросальпингография (ГСГ), или метросальпингография, позволяет получить рентгеновские снимки анатомических особенностей матки и труб. Для этого через цервикальный канал в полость матки вводится рентгеноконтрастное вещество (уротраст, урографин и др.) и через определенные промежутки времени делаются рентгеновские снимки. При нормальном состоянии труб контрастное вещество, пройдя через трубы, проникает в брюшную полость и на рентгеновских снимках определяется в виде хорошо различимых пятен. Если этого не происходит, соответственно, трубы непроходимы. Кроме того, ГСГ позволяет оценить анатомические изменения труб и матки. Одно из преимуществ метросальпингографии – отсутствие необходимости в общем наркозе или местном обезболивании для осуществления исследования. Но следует отметить, что у многих женщин вызывает болезненные ощущения и дискомфорт. Главный недостаток рентгеновских снимков – они не позволяют оценить степень выраженности спаечного процесса, приведшего к непроходимости маточных труб и установить наличие спаек вокруг яичников, очаги эндометриоза
Соногистеросальпингоскопия (СГСС)
Соногистеросальпингоскопия (СГСС) – это УЗИ-исследование состояния внутренних половых органов. Данная процедура схожа с ГСГ, однако вместо рентгеновского аппарата используется прибор для УЗИ, а вместо контрастного вещества – физраствор, фурацилин или раствор глюкозы. Результаты этой процедуры менее точны, чем полученные при ГСГ, однако она более проста для проведения. Недостатки такие же, как при гистеросальпингографии.
Фертилоскопия
Фертилоскопия (трансвагинальная гидролапароскопия) – метод диагностики заболеваний органов малого таза трансвагинально, с помощью оптической системы.
Фертилоскопия проводится под внутренним наркозом или с применением местной анестезии. Вся процедура, в результате которой не остается послеоперационных рубцов, занимает 15-20 минут. После нее женщине достаточно провести в стационаре 2-3 часа, тогда как после лапароскопии потребовалось бы пребывание под наблюдением от 2 до 3 суток.
В ходе процедуры в полость малого таза через задний свод влагалища вводится оптическая система и небольшое количество специальной жидкости, для создания рабочего пространства. После ее введения петли кишечника поднимаются вверх, а яичники и маточные трубы остаются на своих местах, позволяя их детально рассмотреть. Это возможно благодаря используемой при фертилоскопии эндовидеокамеры, которая передает изображение на монитор. Для проверки проходимости маточных труб вводится раствор метиленового синего. Главный недостаток-это отсутствие возможности достаточных хирургических манипуляций в области малого таза и ограниченный доступ к органам малого таза.
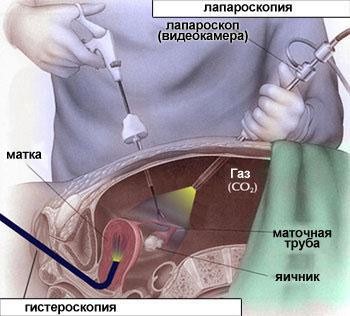
Лапароскопия
Используя диагностику трубного бесплодия при помощи СГСС и ГСГ, врач может оценить, прежде всего, проходимость труб. В то же время оценить характер и степень спаечного процесса вокруг фаллопиевых труб и яичников, другие возможные причины бесплодия (эндометриоз) более трудно.
Для оценки состояния наружной поверхности придатков может быть применена диагностическая лапароскопия. Эта процедура требует проведения наркоза. Специальный прибор в виде тонкой трубки (лапароскоп) через прокол чуть ниже пупка, вводится в брюшную полость.
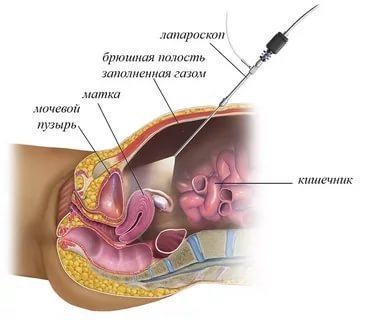
Лапароскоп позволяет врачу, непосредственно наблюдая за состоянием внутренних органов, определить выраженность спаечного процесса и его локализацию.
Главное преимущество – с помощью этого метода можно проводить диагностику непроходимости маточных труб, которая, при необходимости, может сочетаться с оперативным вмешательством. При выполнении операции можно ликвидировать обнаруженные спайки, провести операцию на маточных рубах, выявить и удалить очаги эндометриоза, независимо от распространенности процесса.
Главный недостаток – это хирургическое вмешательство проводится под общим наркозом, через небольшие, около 5-10 мм разрезов, с наложением швов. В редких случаях, как и любая операция, лапароскопия может сопровождаться некоторыми осложнениями.
Лечение трубного бесплодия (непроходимости маточных труб)
В большинстве случаев поражение эпителия, вследствие воспаления, приводит к его атрофии и носит необратимый характер. Если причинами трубного бесплодия являются функциональные нарушения, то для их устранения можно прибегнуть к консервативному лечению. Но на данный момент не существует доступных методов диагностики, которые точно установят, что причиной бесплодия является именно нарушение функции маточных труб. Поэтому, после перенесенного воспалительного процесса органов малого таза, трудно предположить последствия: сформировались спайки и/или нарушена функция маточных труб. Следовательно, в комплексную терапию острых воспалительных процессов сразу включают различные методы физиолечения и препараты, препятствующие образованию спаек.
Следует отметить, что различные воспалительные процессы, характерные для малого таза, могут протекать как с незначительными симптомами, на которые большинство из нас просто не обратит внимания, так и совсем без жалоб.
Например, это может быть небольшая температура в течение 1-2 дней, или незначительные боли внизу живота в течение 1-2 дней, или изменение характера выделений. Указанные жалобы могут сигнализировать об инфицировании, которое в исходе даст спаечный процесс или приведет к нарушению функции маточных труб. Поэтому, зачастую, у пациенток при выполнении лапароскопии по поводу бесплодия, диагностируется спаечный процесс, но жалобы при этом отсутствуют. Сформировавшиеся спайки так же невозможно устранить консервативными методами терапии.
Операцией лапароскопией может быть вылечена частичная непроходимость маточных труб. Следует отметить, что успех операции во многом определяется выраженностью спаечного процесса и квалификацией хирурга.
Если повреждения труб были незначительными, то после операции, наступление беременности наблюдается у 50-60% пациенток.
При непроходимости ампулярных отделов маточных труб, вызванной наружными спайками, частота наступления беременности после реконструктивно-пластических операций составляет 5-20%.
Если повреждены фимбрии, которые определяют попадание и движение яйцеклетки по трубе, особенно с исходом в гидросальпинкс, результативность операции намного ниже, около 10%.
Важно знать, что при лечении непроходимости маточных труб данную операцию имеет смысл проводить только один раз!
При полной непроходимости все эти меры не работают. Даже если будут ликвидированы спайки и трубы снова станут полыми каналами, их функция уже не восстановится, ввиду уничтожения реснитчатого эпителия, выстилающего их внутреннюю поверхность. В этом случае не имеет смысла проводить лечение трубного бесплодия, потому что, по сути, маточные трубы больше не могут участвовать в репродуктивной функции. В этом случае наиболее результативным методом преодоления бесплодия является экстракорпоральное оплодотворение (ЭКО). После того, как оплодотворение гарантированно произошло, яйцеклетку внедряют в полость матки, минуя поврежденные фаллопиевые (маточные) трубы.
- Эндокринное бесплодие
Эндокринология – это наука о гормонах. Слово «гормон» произошло от греческого слова «стимул».
Гормоны — это сигнальные химические вещества, которые вырабатываются в определенных органах и действуют на другие органы, стимулируя и управляя их деятельностью. Они осуществляют связь между органами. Это один из видов связи в организме. Гормоны вырабатываются и разносятся кровотоком как радиоволны. Так они воздействуют на далеко расположенные органы, не имея непосредственно физической связи с ними. Внизу коротко мы остановимся на описании гипоталамо-гипофизарной системы, для того чтобы понимать, откуда «растут ноги» при эндокринном бесплодии. Но учитывая, что это может быть немного скучно, данный раздел можно и пропустить.
Гипоталамус — небольшая область в мозге, включающая в себя большое число групп клеток, которые регулируют нейроэндокринную деятельность мозга и постоянство внутреннего состояния организма человека.
Вместе с гипофизом, гипоталамус образует единую гипоталамо-гипофизарную систему. В этой системе гипоталамус высвобождает различные рилизинг – гормоны: кортикотропин-рилизинг-гормон, соматотропин-рилизинг-гормон, тиреотропин-рилизинг- гормон, гонадотропин-рилизинг-гормон и дофамин; управляет выделением гормонов гипофиза; является центральным связующим звеном между нервной и эндокринной системами. Синтез и секреция гипофизом пролактина в основном регулируется дофамином. Дофамин тормозит секрецию пролактина гипофизом.
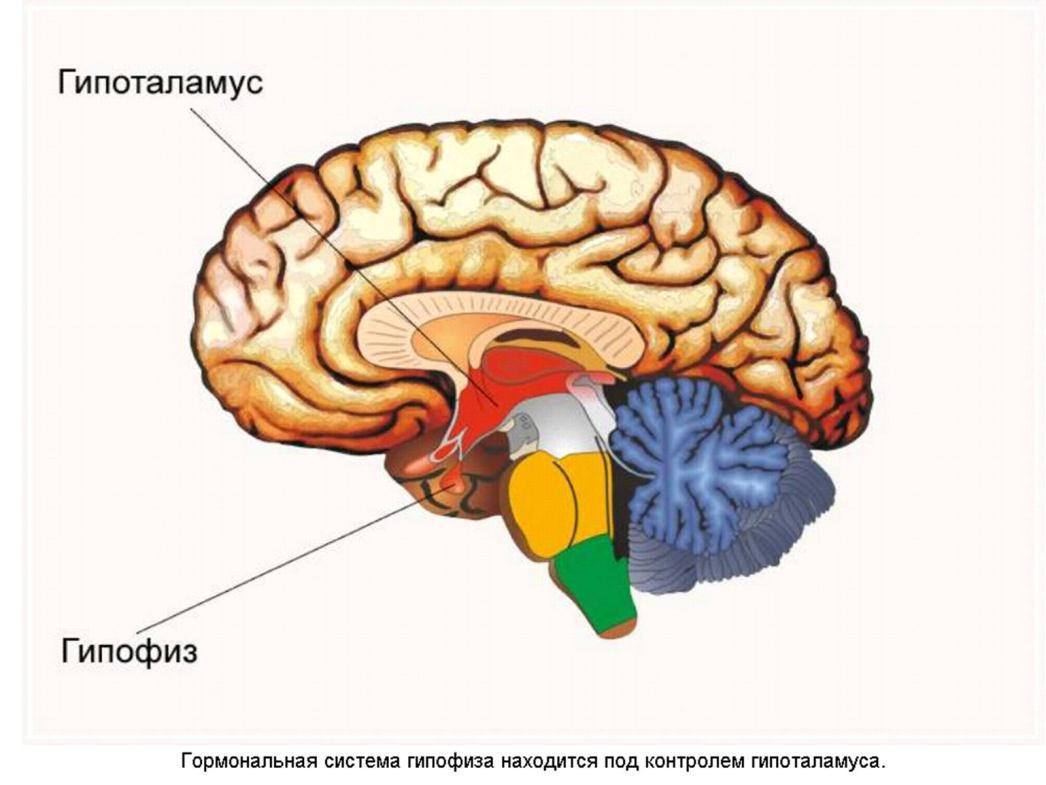
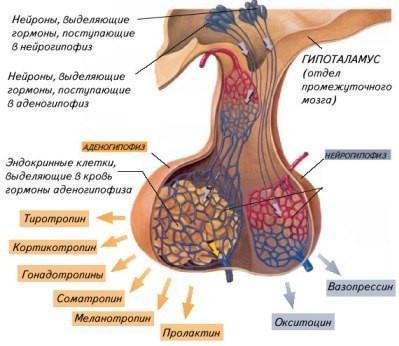
Гипофиз — небольшая, весом менее одного грамма, но очень важная для жизни эндокринная железа, которая управляет деятельностью всех остальных желез. Она расположена в основании черепа и связана с гипоталамической областью головного мозга ножкой. Состоит из трёх долей — передней (железистой, или аденогипофиз), менее развитой средней (промежуточной) и задней (нейрогипофиз).
По важности выполняемых в организме функций гипофиз можно сравнить с ролью дирижёра оркестра, который показывает, когда тот или иной инструмент должен вступать в игру. Гипофиз главный. Он шлет всем приказ.
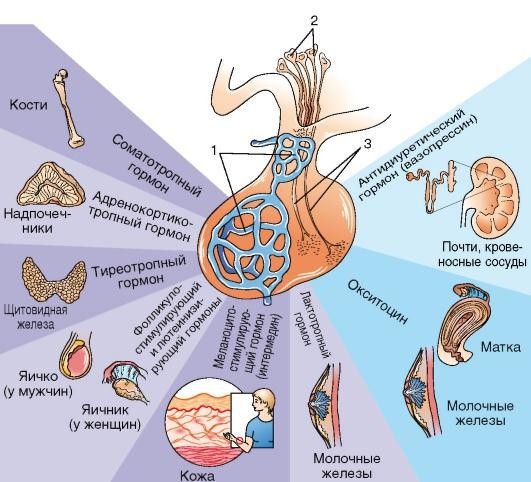
Передняя доля гипофиза — важнейший орган, регулирующий основные функции организма. В нём вырабатывается шесть основных гормонов — тиреотропный гормон (ТТГ), адренокортикотропный гормон (АКТГ), соматотропный гормон (СТГ или гормон роста), лактотропный гормон (пролактин) и два гонадотропных гормона: фолликулостимулирующий гормон (ФСГ) и лютеинизирующий гормон (ЛГ). Посредством этих гормонов, гипофиз воздействует на железы внутренней секреции и регулирует выделение ими соответствующих гормонов.
Так, тиреотропин ускоряет или замедляет работу щитовидной железы.
АКТГ (кортикотропин) регулирует работу коркового вещества надпочечников, управляя выработкой кортизола и андрогенов.
Соматотропин (гормон роста) опосредованно (через соматомедины или инсулиноподобные факторы роста) контролирует процессы роста и развития костной системы, хрящей и мышц.
Пролактин (лактотропный гормон) стимулирует рост молочной железы и ее лактацию в присутствии достаточного уровня женских половых гормонов.
ФСГ и ЛГ (гонадотропины) регулируют функции половых желёз. Они влияют на яички у мужчин и яичники у женщин, стимулируя при этом выработку половых клеток и стероидных гормонов – тестостерона у мужчин, и эстрадиола у женщин.
Задняя доля гипофиза, в отличие от передней, не вырабатывает собственных гормонов. Её роль в организме заключается в накоплении и секреции двух важных гормонов, которые вырабатывают нейросекреторные клетки гипоталамуса — это антидиуретического гормона (АДГ), или вазопрессин, и окситоцин. Вазопрессин участвует в регуляции водного баланса организма, повышает обратное всасывание жидкости в почках. Окситоцин, отвечает за сокращение гладких мышц и, в частности, матки во время родов.
Следует отметить, что регуляция этих систем осуществляется по принципу обратной отрицательной связи, т.е. избыточное накопление гормонов в периферических железах (яичниках, надпочечниках, щитовидной железе) тормозит секрецию рилизинг-факторов гипоталамуса и гормонов гипофиза.
При эндокринном бесплодии, вследствие различных причин (травмы, инфекции, генетические факторы, опухоли, стрессы) нарушается ритм выделения гипоталамусом рилизинг – гормонов, регулирующих функциональную активность гипофиза.
В свою очередь, если нарушается секреция гормонов гипофизом, то это приводит к гормональным изменениям в работе переферических эндокринных желез: яичников, надпочечников, щитовидной железы. Это может явиться причиной недостаточной стимуляции роста фолликулов в яичниках и, как следствие, отсутствие овуляции. Вследствие чего не может возникнуть и беременность. Главным симптомом отсутствия овуляции являются нерегулярные менструации или их отсутствие. Аменорея, то есть полное отсутствие месячных, у пациенток с гормональным бесплодием, возникает не в 100% случаев. Гораздо чаще менструации все же бывают, но со значительными задержками, например, до 2-6 месяцев. Стоит отметить, что овуляция может отсутствовать и при регулярных менструальных циклах. В норме у женщины в течение года может быть 2 — 4 ановуляторных циклов. Соответственно не в каждом цикле, даже при регулярных менструациях женщина может забеременеть. При совершении полового акта в оптимальное для зачатия время, вероятность наступления беременности в течение одного овуляторного менструального цикла составляет лишь 20%.
Бесплодие и гиперпролактинемия.
Гиперпролактинемия (повышение уровня пролактина в сыворотке крови), подразделяется на физиологическую (при беременности, лактации, у новорожденных), бессимптомную (биохимическую) и патологическую.
Причины гиперпролактинемии.
- Одной из причин гиперпролактинемии является первичное развитие в гипофизе опухоли (аденомы), которая возникает вследствие соматической мутации; конкретная мутация до настоящего времени не идентифицирована.
- Этиология идиопатической гиперпролактинемии, при которой отсутствуют аденома гипофиза и другие видимые причины повышения уровня пролактина, неизвестна.
- Причиной развития гиперпролактинемии, в сочетании с другими гипоталамо-гипофизарными заболеваниями, как правило, является нарушение анатомических взаимоотношений гипофиза и гипоталамуса. В результате этого происходит сдавливание ножки гипофиза, нарушается поступление в него из гипоталамуса дофамина, который снижает продукцию пролактина. Любые факторы, приводящие к снижению продукции дофамина, начиная от приема ряда медикаментов, заканчивая многими соматическими и эндокринными заболеваниями, могут обусловить развитие гиперпролак-тинемии. Так, например, хронический дефицит гормонов щитовидной железы приводит к повышению уровня гормона пролактина.
Гормон пролактин находится в крови в нескольких формах. Условно их обозначают так:
- большой пролактин или макропролактин
- малый пролактин или микропролактин
- гликозилированная форма
Биологические эффекты у каждой формы свои. Какие-то менее активны, какие-то более. Наиболее активным считается микропролактин, потому что именно эта форма больше всего имеет родство к рецептору.
Если вы не знаете, то мы немного поясним. Каждый гормон, чтобы оказать свое биологическое действие, сначала связывается с рецептором на поверхности клетки. Конфигурация гормона подходит к рецептору, как ключик к замку. У каждого гормона — свой рецептор, т.е. свой замок.
Пролактин с большой молекулярной массой — макропролактин, не обладает биологической активностью. Микропролактин, благодаря своим малым размерам, имеет большую степень проходимости к рецепторам, следовательно, оказывает более сильное воздействие.
Макропролактинемия не сопровождается явной симптоматикой, не требует лечения и обычно выявляется случайно (бессимптомная, биохимическая гиперпролактинемия).
Патогенез
Избыточная секреция пролактина блокирует циклическое выделение гонадотропин-рилизинг-гормона, что приводит, в свою очередь, к снижению цикличности выделения ЛГ- и ФСГ-гормонов, гипоэстрогении и ановуляции.
Ряд симптомов при повышении уровня пролактина, обусловлен его экстрагенитальным действием:
- увеличение конверсии (перехода) углеводов в жиры способствует ожирению;
- высокийуровеньпролактинавызываетнарушение
метаболизма надпочечниковых андрогенов — дегидроэпиандростерона и дегидроэпиандростерон-сульфата, что ведет к развитию «мягкой» гиперандрогении (гирсутизм, акне -у 40% больных);
- гиперпролактинемия способствует формированию синдрома остеопении, влияя на обмен витамина D, что усугубляется дефицитом эстрогенов;
- пролактин вызывает лактацию и понижает либидо;
- при длительно существующей гиперпролактинемии, возможно формирование вторичного синдрома поликистозных яичников с повышением уровня яичниковых андрогенов.
Эпидемиология
Пролактинома является наиболее частой функционирующей аденомой гипофиза. Микропролактиномы встречаются в несколько раз чаще, чем макропролактиномы, при этом в большей степени у женщин. Макропролактиномы встречаются с одинаковой частотой у лиц обоего пола. Суммарно, патологическая и биохимическая гиперпролактинемия встречается в 1 случае на 500 человек взрослого населения. Гиперпролактинемия обнаруживается примерно у 8 % женщин с олигоменореей. Средний возраст женщин при дебюте заболевания — 25-30 лет, мужчин — 45-50 лет.
Клиническая картина вариабельная.
Может наблюдаться:
- бессимптомное течение (даже в случае значительного повышения уровня пролактина);
- или с выраженной симптоматикой: аменорея (отсутствие месячных), галакторея (процесс выделения из одной иди двух грудных желез молозива, молока или молокоподобной
жидкости), бесплодие.
Повышенный уровень гормона при лактации оказывает ановуляторное действие на яичники, что может снизить вероятность беременности при кормлении ребенка грудью. Поэтому, если перерыв между кормлениями составляет меньше 4 часов, вероятность наступления беременности минимальна. Если перерыв между кормлениями больше, то шансы забеременеть возрастают.
Диагностика.
Однократное обнаружение в крови повышенного уровня про-лактина еще не позволяет установить диагноз.
В связи с тем, что секреция ПРЛ подчиняется циркадным суточным ритмам (максимальная выработка гормона отмечается во время ночного сна, минимальная — в утреннее время), и меняется в зависимости от фазы менструального цикла (повышение уровня в периовуляторный период и в лютеиновую фазу), забор крови следует проводить в начале первой фазы менструального цикла, в 8–9 часов утра.
При выявлении умеренной гиперпролактинемии целесообразно проведение троекратных исследований гормона. Сам по себе уровень пролактина может косвенно свидетельствовать о причине гиперпролактинемии. Так, при уровне пролактина более 3000 мЕд/л, как правило, имеет место аденома гипофиза. При идиопатической и медикаментозной гиперпролактинемии он существенно ниже. Независимо от этиологических признаков, которые приводят к повышению пролактина в крови, важно уточнять, какая его фракция превалирует.
Если макропролактин повышен, а микропролактин имеет нормальные показатели, то о патологии говорят редко. К тому же, это повышение не вызывает объективной симптоматической картины. Это обусловлено слабой гормональной активностью макропролактина. В случае повышения биологически активного микропролактина (мономерный пролактин, биоактивный пролактин), проявляются и прогрессируют все клинические признаки патологического состояния.
Для определения доли макропролактина с общего количества концентрации пролактина в крови, проводиться специальная методика – реакция осаждения иммунных комплексов полиэтиленгликоля (ПЭГ).
Эта методика определяет уровень микропролактина (мономерного). Пост-ПЭГ определяется в момент выпадения в осадок макропролактина, а микропролактин остается. Когда микропролактина остается менее 40 % от исходного, можно считать, что имеется значимое количество — макропролактина (он как раз отсеялся при выполнении данной методики).
Это хороший вариант, можно сказать, вариант нормы, т.к. имеется повышение биологически неактивного пролактина.
Если же микропролактина больше 60 %, то считается, что в крови нет значимого количества биологически неактивной фракции гормона. Это плохой вариант, так как преобладает микропролактин (биологически активный). Если определяется промежуточный результат (40-60 %), необходимо перепроверить кровь еще раз через некоторое время.
Для исключения симптоматических форм гиперпролактинемии необходимо исследовать функциональное состояние щитовидной железы, исключить синдром поликистозных яичников, нервно-рефлекторные и медикаментозные влияния.
При гиперпролактинемии, с целью визуализации аденомы, необходимо выполнить МРТ головного мозга. В связи с более частым выявлением аденом на МРТ, разной клинической значимостью, более точной топической диагностикой их делят на микроаденомы (диаметр аденомы до 10 мм) и макроаденомы (диаметр более 10 мм).
Лечение.
Медикаментозная терапия агонистами дофамина показана при микро — и макропролактиномах, а также при идиопатической (когда причина неизвестна) гиперпролактинемии. Стимулируя дофаминергические рецепторы в гипофизе, эти препараты блокируют синтез и выделение пролактина, подавляют рост пролактинсекретирующих аденом гипофиза.
Нормализация секреции пролактина у большинства больных приводит
- восстановлению циклической активности гипоталамуса, повышению продукции гонадотропных гормонов, восстановлению двухфазного менструального цикла. Кроме того, происходит значительное уменьшение размера истинных пролактином, в связи с этим медикаментозная терапия эффективна и при макропролактиномах, которые могут сопровождаться хиазмальным синдромом (выпадение полей зрения) и другой неврологической симптоматикой.
Используют две группы агонистов дофаминовых рецепторов (АДР)
- препараты бромокриптина (применяют, начиная с 1,25 мг 1-3 раза в день во время еды: побочные явления (тошнота, гипотензия, запор, обычно кратковременны и исчезают при уменьшении дозы);
- препараты каберголина (принимают, начиная с 0,25-2 мг 1-2 раза в неделю; имеют меньше побочных эффектов; вызывают значительно более длительное и эффективное подавление продукции пролактина; при необходимости дозировка может быть увеличена до 4,0 мг и более).
При идиопатической гиперпролактинемии, при котором отсутствуют аденома гипофиза и другие видимые причины повышения уровня пролактина, можно использовать гомеопатические препараты, например – мастодинон.
Мастодинон — это комплексное гомеопатическое средство, под влиянием компонентов которого отмечается снижение концентрации пролактина в крови. В его состав входит 6 растительных компонентов: витекса священного, васелистниковидного стеблелиста, цикломена европейского, чилибухи игнации, ириса разноцветного, тигровой лилии. Выпускается Мастодинон в виде таблеток для рассасывания и капель для приема внутрь. Применяется по 1 драже 2 раза в сутки внутрь или по 30 капель 2 раза в сутки.
Принимать препарат нужно за 20 минут до или 40 минут после еды. Лечение продолжают в течение как минимум 3 месяцев. Значительное улучшение состояния отмечается через 6 недель регулярного приема таблеток или капель. В случае рецидива заболевания после завершения курса лечения, следует проконсультироваться со своим врачом.
Хирургическое лечение показано при макропролактиномах, устойчивых к агонистам дофаминовых рецепторов (АДР).
При выявлении феномена макропролактинемии, дозировка АДР должна рассчитываться по уровню мономерного, биологически активного пролактина. В период подбора оптимальной дозы препарата уровень ПРЛ должен измеряться ежемесячно, а после достижения нормальных значений
— 1 раз в 3–6 месяцев. Оптимальной считается доза препарата, позволяющая, наряду с контролем размеров опухоли и уровня ПРЛ, ликвидировать клинические проявления гипогонадизма.
У большинства пациентов, получающих медикаментозную терапию в общепринятых дозах, достигается нормализация уровня ПРЛ и сокращение размеров аденомы. Для оценки степени ремиссии заболевания возможна плановая отмена АДР сроком на 1–2 месяца 1 раз в 2 года под контролем уровня ПРЛ и клинической симптоматики. В большинстве случаев медикаментозная терапия пролактином назначается на длительный срок до 2 и более лет.
Прогноз
При истинных микро- и макропролактиномах терапия дофаминомиметиками эффективна, в подавляющем большинстве случаев, как в плане уменьшения размеров опухоли, так и в плане нормализации уровня пролактина и фертильности. Длительные (более 5 лет) ремиссии, после прекращения лечения, наблюдаются у 5—10 % больных. После наступления менопаузы самопроизвольная ремиссия гиперпролактинемии наступает у 1/3 пациенток. Нередко ремиссия развивается после родов.
Это интересно знать.
Важно учитывать, что на уровень гормона в крови влияет прием различных лекарственных препаратов и веществ (антидепрессантов, антигипертензивных, желудочно-кишечных препаратов и др.); пиво – также повышает концентрацию пролактина в крови.
Бесплодие и гиперандрогенемия.
Нарушение репродуктивной функции женщины может явиться следствием повышения уровня мужских половых гормонов в крови (андрогенов), избыток которых в организме женщины связан с нарушением работы яичников или надпочечников, которые ответственны за выработку этих гормонов.
Остановимся коротко на основных терминах, которые используются при данной патологии.
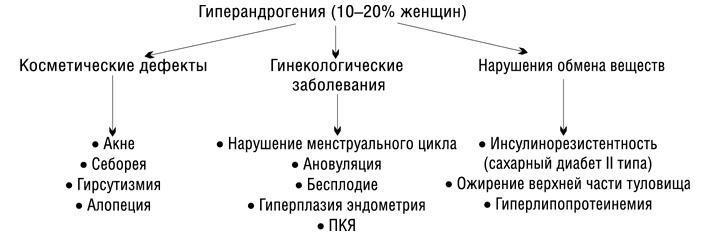
Гиперандрогенемия — повышенная концентрация андрогенов в сыворотке крови, которая проявляется, в большинстве случаев, андрогенизацией (гирсутизм, алопеция, угревая сыпь). Так, частота гирсутизма при гиперандрогении составляет около 80%.
Распространенность гиперандрогении составляет 10%.
Андрогенизация — проявление симптомов, типичных для высокого уровня андрогенов (гирсутизм, алопеция, угревая сыпь и вирилизация).
Гирсутизм – заболевание, при котором у женщин рост и распределение терминальных волос происходит по мужскому типу.
Алопеция — видимое на глаз разрежение волос на голове с появлением проплешин. Наиболее частая форма – андрогенетическая алопеция (распространенность составляет 30-40%), чаще наблюдается у женщин в перименопаузе (за счёт физиологического повышения уровня андрогенов).
Угри (акне) — заболевание сальных желез волосяных фолликулов. Распространенность обыкновенных угрей среди подростков составляет 35-90% . У юношей акне наблюдается чаще, чем у девушек, а в более позднем возрасте соотношение мужчин и женщин с угревой сыпью обратное –у женщин больше, чем мужчин. С возрастом частота акне уменьшается: у женщин 20-29 лет она составляет 51%, старше 50 лет – 15%.
Вирилизация — появление у женщин мужских черт телосложения и мужских вторичных половых признаков (низкий тембр голоса, увеличение гортани, мужские пропорции тела, увеличение клитора гирсутизм).
Гиперадрогения – андрогенизация без повышения уровня андрогенов в крови (гиперандрогенемии).
Гипертрихоз — рост волос на участках тела, не характерный для данного пола, и появление терминальных волос на участках, где в норме растут пушковые волосы.
Симптомы андрогенизации – одна из причин обращения к гинекологу за консультацией. Данные симптомы могут встречаться при следующих заболеваниях:
- синдром поликистозных яичников (СПКЯ) (см. раздел СПКЯ);
- врожденный адреногенитальный синдром (АГС);
- андрогенпродуцирующия опухоль яичника (редкая опухоль – 1% от всех опухолей яичника);
- синдром Кушинга.
При симптомах андрогенизации необходимо сдать следующие анализы на гормоны: общий тестостерон, ДГЭАС, 17 – ОНР, эстрадиол, ЛГ, ФСГ, ТТГ, пролактин, кортизол. При необходимости на втором этапе проводят пробы с дексаметазоном, пробу с гормоном АКТГ.
Внизу остановимся коротко на каждом из этих заболеваний.
Врожденный АГС — адреногенитальный синдром, или врожденная гиперплазия надпочечников.
Врожденный АГС, или врожденная гиперплазия надпочечников — общее название нескольких наследуемых дефектов ферментов, участвующих
- биосинтезе кортизола в надпочечниках. Наиболее частым из них является недостаточность фермента 21 – гидроксилазы (в 95% случаев).
- зависимости от степени недостаточности дефектного фермента различают тяжелую (классическую) и легкую (неклассическую, или позднею) формы АГС.
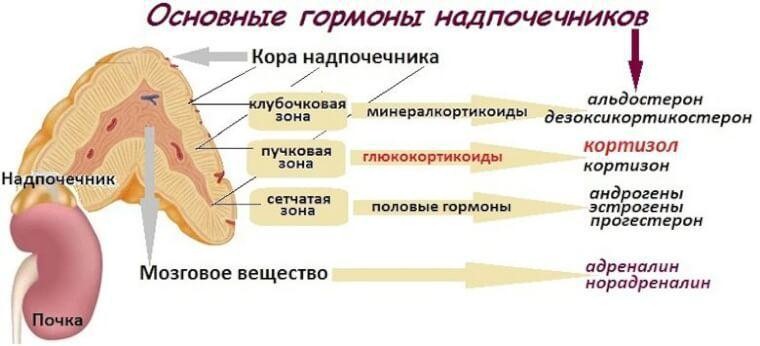
Биосинтез стероидных гормонов происходит в коре надпочечников:
- минералокортикоиды синтезируются в клубочковой зоне,
- глюкокортикоиды – в пучковой,
- половые гормоны — в сетчатой зоне.
Главными источниками половых гормонов являются половые железы. Продукции половых гормонов корой надпочечников придают функ-циональное значение только в необычных условиях, когда на путях биосинтеза в надпочечных железах появляются дефекты ферментов.
При АГС, в зависимости от дефектного фермента, отмечаются различные типы нарушения биосинтеза стероидных гормонов.
Внизу представлена схема образования гормонов с участием различных ферментов.
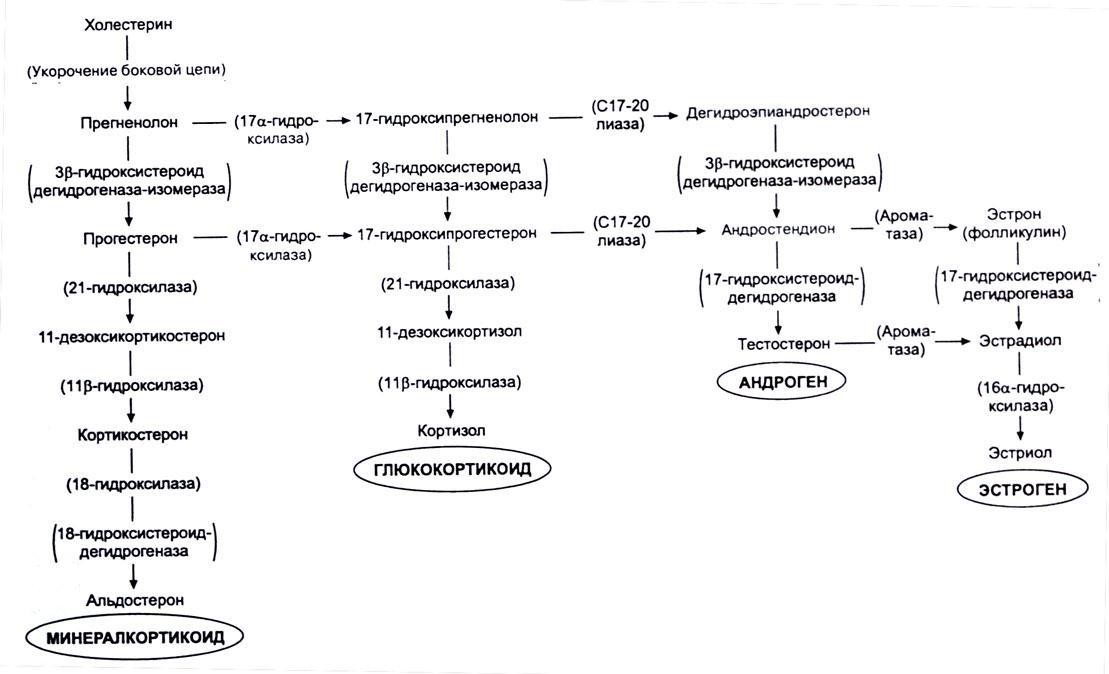
Например, при недостаточности фермента 21 – гидроксилазы, нарушается превращение 17 – ОНР (17 – гидроксипрогестерона) в 11 – дезоксикортизол, в результате снижается синтез кортизола в надпочечниках,
- ответ повышается секреция АКТГ гипофизом. АКТГ стимулирует кору надпочечников, в результате чего, из 17 – ОНР синтезирируются андрогены, уровень которых повышается.
Лабораторная диагностика непосредственно гиперандрогенемии основывается на определении общего тестостерона, ДГЭАС и 17 – ОНР.
При определении концентрации андрогенов в сыворотке крови, говорить о принадлежности этих гормонов к тому или иному секретирующему органу — надпочечникам или половым железам, можно лишь условно.
Так, 50% ДГЭАС образуется в коре надпочечников, 25% в яичниках и 25% в периферических тканях. 50% тестостерона синтезируется в периферических тканях, остальное количество – в яичниках 25% и коре надпочечников 25%.
Классическая форма АГС обычно диагностируется в детстве, и поэтому рассматривать ее мы не будем.
Неклассическая (поздняя, или легкая) форма АГС проявляется только клиническими признаками избыточной выработки андрогенов, усиливающимися с возрастом. Клинические признаки избытка андрогенов у подростков и взрослых: угри – 30% случаев, гирсутизм – 60-90% случаев, алопеция – меньше 10% случае, нарушение менструального цикла, например олигоменорея – 55% случаев или аменорея – 5% случаев, бесплодие – 15% случаев.
Следует обратить внимание, что для уменьшения проявлений андрогенизации, глюкокортикоиды не являются препаратами выбора. При бесплодии, для стимуляции овуляции кортикостероиды применяются только в случае АГС с поздним началом. Обычно назначают гидрокортизон в дозе 10-20 мг 2 раза в сутки или дексаметазон в дозе 0,25- 0,5 мг 1 раз в сутки.
Андрогенпродуцирующая опухоль.
Андрогенпродуцирующие опухоли проявляются быстрым проявлением симптомов андрогенизации. В том случае, если уровень андрогенов невысокий, но гирсутизм или вирилизация прогрессируют, то в первую очередь, следует исключить андрогенпродуцирующую опухоль. Опухоли поражают в основном яичники и реже выявляются в надпочечниках.
Диагностика: УЗИ яичников, МРТ надпочечников.
Синдром Кушинга
Синдром гиперкортицизма или синдром Иценко — Кушинга объединяет группу заболеваний, при которых происходит длительное хроническое воздействие на организм избыточного количества гормонов коры надпочечников, независимо от причины, которая вызвала повышение количества этих гормонов в крови. В основе патологических изменений со стороны большинства органов и систем, при синдроме Кушинга, в первую очередь, лежит гиперпродукция кортизола.
Синдром Кушинга также может возникать при первичном поражении коры надпочечников (при доброкачественных или злокачественных опухолях коры надпочечников, при гиперплазии коры надпочечников).
Гормонально-активная опухоль коры надпочечника называется кортикостеромой. Она продуцирует в кровь избыточное количество глюкокортикоидов. При этом, из-за избыточного количества глюкокортикоидов, по механизму обратной связи, снижается количество адренокортикотропного гормона гипофиза, а оставшаяся ткань надпочечников подвергается атрофическим изменениям.
Синдром гиперкортицизма может возникнуть при лечении различных заболеваний гормонами коры надпочечников — глюкокортикоидами, в случае, если происходит передозировка этих препаратов. Это является частым вариантом, с которым сталкиваются врачи большинства специальностей. Болеют в основном лица в возрасте 20—40 лет.
Гиперсекреция кортизола, также довольно часто может наблюдаться при ожирении, хронической алкогольной интоксикации, беременности и некоторых психических и неврологических заболеваниях — такое состояние называется «Псевдо-Кушинга синдром» или «функциональный гиперкортицизм», который не вызван опухолями, но клиническая картина наблюдается как и при истинном синдроме Иценко — Кушинга.
Помимо синдрома, отдельно выделяют болезнь Иценко — Кушинга — это нейроэндокринное заболевание, характеризующееся повышенной продукцией гормонов коры надпочечников, которая обусловлена избыточной секрецией АКТГ клетками гиперплазированной или опухолевой ткани гипофиза (в 90% это микроаденома).
Диагностика
При подозрении на синдром Иценко — Кушинга (повышение уровня общего кортизола в сыворотке крови) выполняются различные пробы с дексаметазоном и выполняется двух- или трехкратное определение свободного кортизола в суточной моче.
Лечение заболевания зависит от результатов обследования, т. е. от того, в какой именно области выявлен патологический процесс, приведший к возникновению гиперкортицизма.
На сегодняшний день единственным, действительно эффективным методом лечения болезни Иценко–Кушинга, возникшей в результате аденомы гипофиза, является хирургический, при котором проводится селективная транссфеноидальная аденомэктомия. Эта нейрохирургическая операция показана при выявлении аденомы гипофиза, локализация которой чётко была установлена при обследовании. У подавляющего числа больных, эта операция дает положительные результаты. Достаточно быстро происходит восстановление нормального функционирования гипоталамо-гипофизарной системы, в 70–80 % случаев наступает стойкая ремиссия заболевания. Однако у 10–20 % пациентов может возникнуть рецидив.
Хирургическое лечение болезни Иценко–Кушинга обычно сочетается с лучевой терапией, а также методом деструкции гиперплазированных надпочечников (т. к. масса желез увеличивается в результате длительного гормонального сбоя).
При наличии противопоказаний к хирургическому лечению аденомы гипофиза (тяжелое состояние пациентки, наличие тяжелых сопутствующих заболеваний и др.), проводится медикаментозное лечение.
Применяются препараты, которые подавляют секрецию адренокортикотропного гормона (АКТГ), повышение уровня которого и приводит к гиперкортицизму. На фоне такого лечения, при необходимости, обязательно проводится и симптоматическая терапия гипотензивными, сахароснижающими препаратами, антидепрессантами, лечение и профилактика остеопороза и др.
Если причиной возникновения гиперкортицизма стали опухоли надпочечников или других органов, то необходимо их удаление. При удалении пораженной надпочечниковой железы, с целью профилактики гипокортицизма в дальнейшем, больным будет необходима длительная заместительная гормональная терапия под постоянным контролем врача.
Адреналэктомия (удаление одного или двух надпочечников) в последнее время используется редко, только в случае невозможности лечения гиперкортицизма другими способами. Эта манипуляция приводит к хронической надпочечниковой недостаточности, требующей пожизненной заместительной гормональной терапии.
Все пациенты, которым было проведено или проводится лечение этого заболевания, нуждаются в постоянном наблюдении эндокринолога, а при необходимости, и других специалистов.
Бесплодие и нарушение функции щитовидной железы.
Нарушение овуляции и, как следствие, эндокринное бесплодие может наблюдаться при нарушении функции щитовидной железы (ЩЖ), которое проявляется в ее гипо- или гиперфункции.
Остановимся коротко на терминах.
Первичный гипотиреоз — снижение функции ЩЖ, связанное с недостаточным синтезом ее гормонов; на его долю приходится 99% всех случаев гипотиреоза.
Первичный, манифестный гипотиреоз — характеризуется снижением свободного тироксина (Т4 свободный) и повышением уровня ТТГ в сыворотке крови.
Первичный субклинический/латентный гипотиреоз — характеризуется нормальным уровнем свободного тироксина (Т4 свободный) и трийодтиронина (Т3), но повышением уровня ТТГ в сыворотке крови.
Центральный гипотиреоз (встречается редко) — недостаточность функции ЩЖ, связанная с недостаточностью ее церебральной стимуляции. Низкий уровень свободного тироксина (Т4 свободный) и трийодтиронина (Т3) и ТТГ.
Первичный гипертиреоз — избыточная функция ЩЖ, которая вырабатывает чрезмерное количество гормонов.
Первичный манифестный гипертиреоз — повышение уровня свободного Т4 и Т3 и снижение уровня ТТГ в сыворотке крови.
Первичный субклинический/латентный гипертиреоз — уровень свободного Т4 и Т3 в сыворотке крови нормальный, а уровень ТТГ снижен.
Центральный гипертиреоз (встречается редко) — повышенная функция ЩЖ, это состояние связано с чрезмерной церебральной стимуляцией ЩЖ.
Диагноз гипотиреоза или гипертиреоза устанавливается по результатам определения в сыворотке крови гормонов: ТТГ и Т4 свободного.
Тиреоидит — неоднородная группа воспалительных заболеваний ЩЖ.
Зоб — морфологические изменения в ЩЖ, независимо от их причины и функции ЩЖ.
Диффузный зоб — увеличение ЩЖ, без образования в ней узлов.
Диагноз зоб и/или тиреоидит устанавливается по данным УЗИ.
Так же в анализе крови можно определить антитериоидные аутоантитела.
Антититериоидные аутоантитела – это антитела, которые нарушают синтез гормонов ЩЖ на разных уровнях. Так могут формироваться антитела
- рецепторам ТТГ (АТ- рТТГ), антитела к пероксидазе ЩЖ (АТ – ТП), антитела к тиреоглобулину (АТ –ТГ).
Одним из распространенных тиреоидитов является аутоиммунный тиреоидит (тиреоидит Хашимото) — это хроническое воспалительное заболевание щитовидной железы аутоиммунного генеза.
Причина болезни — частичный генетический дефект иммунной системы, в результате которого в клетках эндокринных желез происходят специфические морфологические изменения различной степени выраженности (от лимфоплазмоцитарной инфильтрации, до фиброзного замещения ткани щитовидной железы).
При данном заболевании, антитела, вырабатываемые иммунной системой, начинают принимать клетки щитовидной железы за чужеродные. Воздействуя на гормональноактивные клетки щитовидной железы — тиреоциты, антитела вызывают деструктивные изменения в них. Как следствие — снижается функция щитовидной железы и уменьшается выработка тиреоидных гормонов, что приводит к повышению уровня ТТГ. На фоне аутоиммунного тиреоидита, также возможно и временное повышение продукции гормонов — гипертиреоз (тиреотоксикоз).
Если уровень гормонов ЩЖ при тиреоидите не изменен — это состояние называется эутиреоидное, то в таком случае терапия тироксином не показана.
По данным зарубежных исследователей, у женщин, страдающих бесплодием, диагноз гипотиреоза выставляется от 2-х до 34% случаев.
Дефицит тиреоидных гормонов приводит к изменению процессов синтеза, транспорта, обменных процессов и периферических эффектов половых гормонов.
Тиреоидные гормоны стимулируют выработку в печени специального белка, который связывает половые гормоны — эстрадиол, тестостерон и 5-дигидротестостерон. Для гипотиреоза характерно снижение уровня данного печеночного белка в крови, что ведет к увеличению уровня биологически активного тестостерона. Как известно, тестостерон – это мужской половой гормон, который пагубно влияет на женские половые органы (подавляет овуляцию и менструации).
Дефицит гормонов щитовидной железы нарушает инактивацию эстрогенов с образованием их менее активных форм, что приводит к повышению уровня эстрогенов и нарушению адекватного механизма обратной связи в регуляции секреции гонадотропинов (ФСГ, ЛГ). Гонадотропины – это ключевые гормоны в регуляции циклических процессов овуляции и менструации и именно благодаря вышеизложенным причинам, длительный гипотиреоз закономерно приводит к бесплодию.
При длительном дефиците гормонов щитовидной железы повышается уровень пролактина, что вызывает бесплодие, связанное с данным феноменом.
Принято считать, что при гипертиреозе, снижение фертильности происходит в меньшей степени, чем при гипотиреозе.
При гипертиреозе происходит значительное повышение концентрации
- крови белка, который связывает половые гормоны, снижается скорость выведения из крови тестостерона и, в меньшей степени, эстрадиола. Это приводит к увеличению общей концентрации тестостерона в плазме крови. Гиперэстрогения по механизму обратной связи, приводит к снижению концентрации ФСГ. Концентрация прогестерона при этом остается низкой, за счет уменьшения чувствительности яичников к ЛГ, в условиях дефицита ФСГ. В ответ на снижение концентрации прогестерона в крови, по механизму обратной связи, увеличивается образование ЛГ, чему также способствует низкая концентрация свободного тестостерона.
Менструальный цикл.
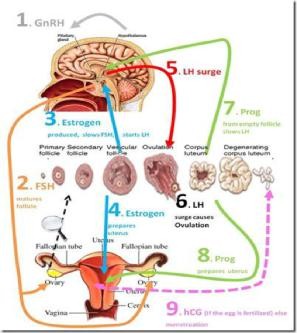
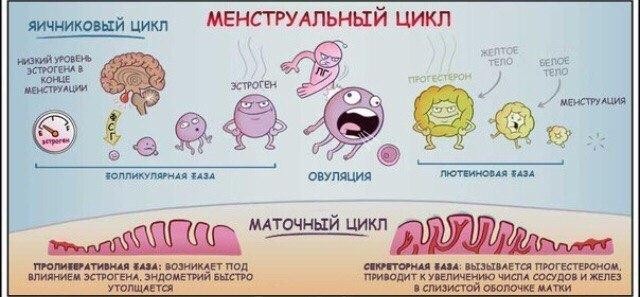
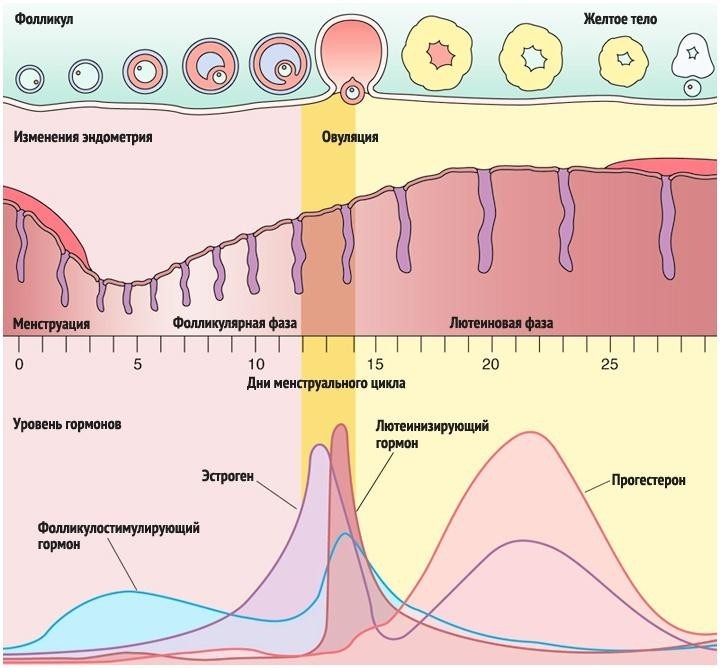
- фолликулярной фазе менструального цикла под влиянием ФСГ гипофиза начинается рост нескольких фолликулов, но стадии полного созревания достигает обычно один фолликул (созреванию и функции фолликула содействует также ЛГ), который называется доминантным.
По мере созревания фолликулов, в их клетках вырабатываются женские гормоны – эстрогены, которые приводят к пролиферации слизистого слоя матки — эндометрия.
Пролиферация – это активное деление клеток, ведущее к утолщению эндометрия. Постепенно другие фолликулы, рост которых в данном цикле начался вместе с доминантным, подвергаются атрезии и обратному развитию. Чем больших размеров достигает доминантный фолликул, тем больше его клетки вырабатывают эстрогенов. Когда количество эстрогенов достигает достаточного уровня для овуляции, происходит резкий выброс в кровь лютеинизирующего гормона (ЛГ), после чего в течение, примерно 24-48 часов, происходит разрыв фолликула — овуляция. На месте разорвавшегося доминантного фолликула формируется желтое тело, которое функционирует
- среднем 14 дней, секретируя при этом прогестерон. Прогестерон даёт начало для второй фазы менструального цикла — лютеинизирующей.
Параллельно с происходящим процессом в яичниках, в матке начинается секреторная фаза. Во время неё эндометрий обильно прорастает сосудами и железами. Яйцеклетка, вместе с фолликулярной жидкостью, попадает в брюшную полость, а в дальнейшем в маточную трубу. В случае, если состоялась встреча яйцеклетки и сперматозоида, то оплодотворение происходит в полости маточной трубы. Если этот процесс не осуществился, то неоплодотворенная яйцеклетка быстро утрачивает свою жизнеспособность (через 12 – 24 ч) и разрушается.
Если беременность не наступает, уровень ЛГ и ФСГ постепенно снижается к концу второй фазы. Эндометрий подвергается некротическим изменениям (сосуды сжимаются, питания не происходит), и затем он отторгается, наступает менструация.
Период развития доминантного фолликула может различаться как у разных женщин, так и у одной и той женщины, в разных фазах цикла. Ниже показаны три картинки — как разные авторы схематично представили физиологию менструального цикла.
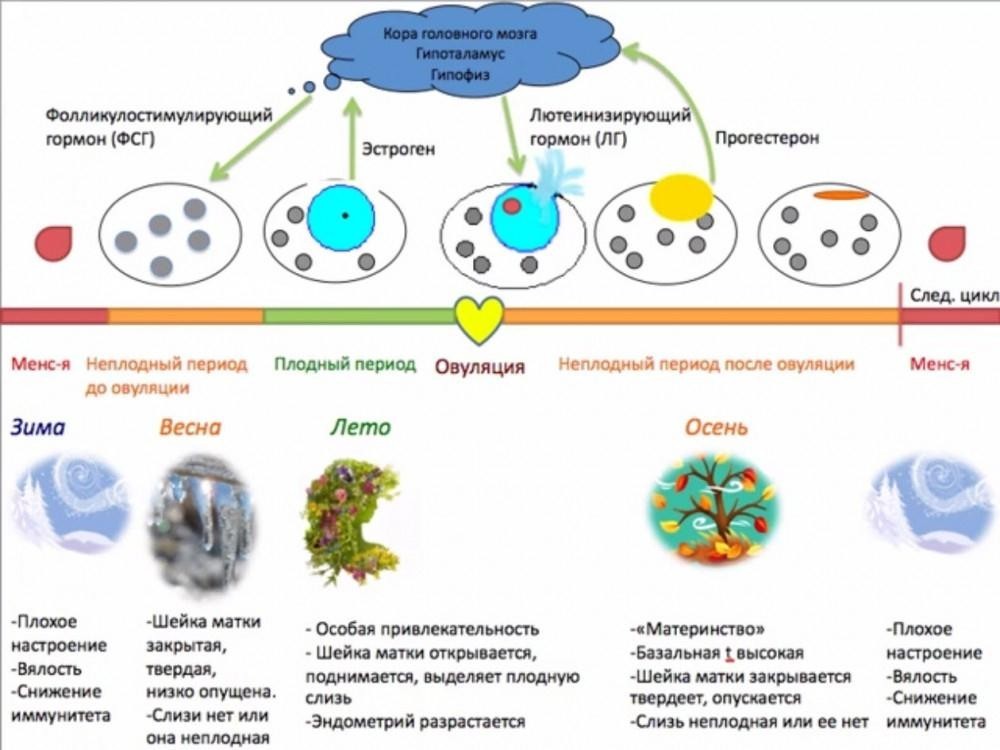
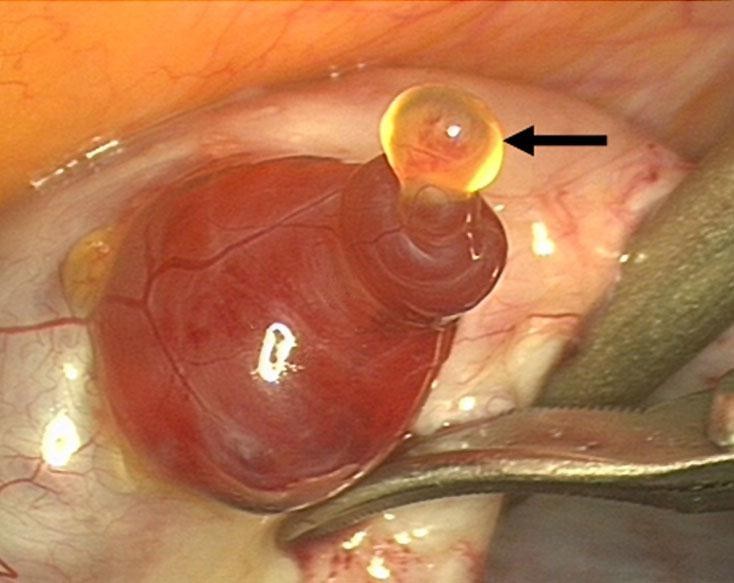
Диагностика овуляции.
О наличии хронической овуляторной дисфункции свидетельствует отсутствие овуляции в 2-х циклах из 3-х. Поэтому все методы для определения овуляции необходимо использовать в 2-3 менструальных циклах.
Для диагностики овуляции (на снимке внизу) можно использовать разные методы:
- использование тест полосок для определения овуляции (более правильно дл определения повышения ЛГ);
- измерение базальной (ректальной) температуры;
- определение прогестерона во второй фазе цикла;
- УЗИ — фолликулометрия.
Использование тест полосок для определения овуляции (более правильно — для определения повышения уровня ЛГ)
На определении момента резкого увеличения уровня ЛГ (лютеинизирующего гормона) в моче и основано действие современных домашних тест-полосок на овуляцию. День начала тестирования нужно определять в зависимости от продолжительности менструального цикла.
Напоминаем, что первым днем цикла является день, когда началась менструация. Длина цикла – количество дней прошедших от первого дня последней менструации, до первого дня следующей. Если у женщины регулярный цикл (всегда одинаковой продолжительности), то начинать делать тесты нужно примерно за 17 дней до начала следующей менструации, так как фаза желтого тела (после овуляции) длится 12-16 дней (в среднем, обычно – 14). Арифметика простая, от длины цикла нужно вычесть 17 дней, полученное число и будет являться днём, с которого нужно начинать определять овуляцию. Например, если обычная длина цикла 28 дней, то тестирование нужно начинать с 11-го дня, а если 35 – то с 18-г.
Если продолжительность цикла непостоянная, то нужно выбрать самый короткий цикл за последние 6 месяцев и использовать его продолжительность для вычисления дня, когда начать тестирование.
При отсутствии регулярности и наличия больших задержек – использование тестов, без дополнительного контроля за овуляцией и фолликулами, не является разумным, как по причине высокой стоимости тестов, так и при низкой их надежности (при использовании тестов раз в несколько дней овуляцию можно пропустить, а использование этих тестов каждый день – себя не оправдает).
При ежедневном использовании (или даже 2 раза в день – утром и вечером) домашние тесты дают хорошие результаты, особенно, совместно с УЗИ.
При использовании ультразвукового контроля, можно не тратить зря тесты, а подождать, пока фолликул достигнет необходимых размеров, примерно около 18-20 мм, когда он способен овулировать. Тогда можно начинать делать тесты каждый день. Тесты можно проводить в любое время дня, но по возможности следует придерживаться одного и того же времени проведения теста. При этом, чтобы концентрация гормона в моче была наиболее высокой, желательно воздержаться от мочеиспускания, как минимум в течение 4-х часов и избегать избыточного потребления жидкости перед началом тестирования, т.к. это может привести
- уменьшению концентрации ЛГ в моче и снизить достоверность результата. Самое лучшее время для тестирования – это утро.